在全球医疗器械监管体系中,日本凭借严谨的分类标准、清晰的监管层级及专业化的审评机构,构建了覆盖医疗器械全生命周期的监管框架。日本将医疗器械依据风险等级实施差异化监管,核心依托《药事法》确立监管准则,由厚生劳动省(以下简称“厚生省”)统筹管理,医药医疗器械局(Pharmaceuticals and Medical Devices Agency,简称PMDA)承担核心审评审批职能,确保医疗器械的、有效与合规性。本文系统梳理日本医疗器械的分类标准、差异化监管方式,深入解析PMDA的机构定位、核心业务及审评要求,为相关从业者提供、的行业参考(本文所指医疗器械不含体外诊断试剂)。
一、日本医疗器械分类标准:基于风险等级的分级体系
日本医疗器械的分类核心遵循“风险等级适配监管强度”原则,依据产品风险等级由低到高,明确分为三大类、四个等级,各类别界定清晰、适用范围明确,为后续差异化监管提供基础依据。
具体分类如下:
1. 一般医疗器械(Ⅰ类):风险等级,主要为结构简单、性高,对人体健康无显著潜在风险的医疗器械,无需复杂的性验证即可保障使用,监管方式以备案为主。
2. 管理医疗器械(Ⅱ类):风险等级中等,产品结构与功能相对复杂,存在一定潜在风险,需通过针对性的认证或审评确保有效性,监管方式分为第三方认证与PMDA审评、厚生省承认两种。
3. 高度管理医疗器械:风险等级,涵盖Ⅲ类、Ⅳ类产品,此类产品技术难度高、直接影响人体生命,对有效性要求,核心监管方式为PMDA审评、厚生省承认,特殊情况下可采用第三方认证。
截至2018年4月1日,日本厚生省已制定946个认证基准、45个承认基准和9个审查指导原则,为各类医疗器械的分类界定、监管实施提供了明确的标准依据,确保分类与监管的科学性、统一性。
二、日本医疗器械差异化监管方式:基于分类的分级管控
依据2013年11月正式实施的《药事法》,日本对不同风险等级的医疗器械采取“分级管控、施策”的监管方式,核心分为产品备案、第三方认证、厚生省承认三种,明确区分适用场景,兼顾监管效率与保障。
(一)一般医疗器械(Ⅰ类):产品备案制
一般医疗器械因其风险等级低,实行简化监管,由备案人向PMDA提交备案申请,提交相关产品信息、性说明等资料,完成备案后即可上市销售。备案制的实施,既降低了低风险医疗器械的上市门槛,又通过PMDA的备案审核,确保产品基本合规。
(二)管理医疗器械(Ⅱ类):第三方认证与PMDA审评结合
管理医疗器械的监管方式根据认证基准是否明确分为两种情形:
1. 有明确认证基准的,由第三方认证机构开展认证工作(截至2016年11月30日,日本共有13家具备资质的第三方认证机构),认证通过后即可上市;
2. 无明确认证基准或产品不符合现有认证基准的,需由PMDA开展技术审评,审评通过后报厚生省进行承认,获得承认后方可上市。
(三)高度管理医疗器械(Ⅲ类、Ⅳ类):以厚生省承认为核心
高度管理医疗器械直接关系人体生命,监管最为严格,核心监管流程为PMDA审评、厚生省承认。同时,针对已有明确承认基准和审查指导原则的高度管理医疗器械,也可由第三方认证机构开展认证工作;若申请认证的产品不符合承认基准或审查指导原则,则需重新向厚生省提交承认申请,经PMDA审评、厚生省承认后,方可上市。
三、PMDA核心解析:日本医疗器械监管的核心执行机构
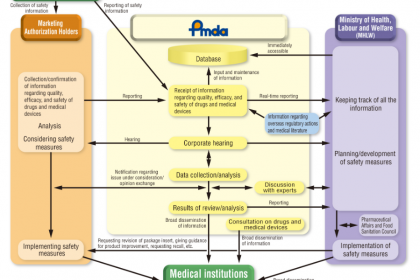
从日本医疗器械的分类监管流程可见,PMDA作为厚生省医药食品局管辖的独立行政法人,是日本医疗器械监管体系的核心执行机构,承担着审评审批、管控、健康损害救济等关键职能,成立于2004年,其工作成效直接决定日本医疗器械的监管水平与产品质量。
(一)PMDA机构概况
PMDA隶属于厚生省医药食品局,为独立行政法人,专注于医疗器械、药品、再生医疗产品等的监管相关工作。截至2017年4月1日,PMDA共有员工812名,其中审查部门575名、对策部门198名、健康损害救济部门39名;据2014年4月公布的数据,PMDA专门负责医疗器械审查的人员达104名,为医疗器械审评工作提供了充足的专业人力支撑。
(二)PMDA核心业务板块
PMDA的业务核心围绕“风险管控、保障”展开,涵盖审查、对策、健康损害救济三大板块,其中审查业务是其针对医疗器械监管的核心职能,具体如下:
1. 审查业务(核心职能)
审查业务聚焦医疗器械上市前的有效性审核,同时覆盖上市后再审查、生产环节监管等,核心职能包括:
- 临床试验相关咨询,为医疗器械临床试验的开展提供专业指导;
- 医疗器械(含新器械、改良器械、仿制器械)的上市前审查、再审查及再评价;
- 申请资料可靠性调查,开展GCP(临床试验质量管理规范)、GLP(非临床研究质量管理规范)、GPSP(良好药品流通规范)符合性评估,确保申报资料真实、合规;
- 生产企业监管,开展GMP(药品生产质量管理规范)、QMS(质量管理体系)、GCTP(良好临床试验用医疗器械质量管理规范)检查,规范企业生产行为;
- 注册认证机构检查,对具备医疗器械认证资质的第三方机构进行监管,确保认证工作合规、严谨;
- 标准制定,参与日本药典等相关标准的编写与调查工作,完善医疗器械监管标准体系。
2. 对策业务
聚焦医疗器械上市后的监测与风险管控,跟踪产品上市后的使用情况,及时发现并处置产品隐患,防范事故发生,保障使用者健康权益。
3. 健康损害救济业务
针对因使用医疗器械、药品等产生的健康损害,提供救济服务,规范救济流程,保障受害者的合法权益。
(三)PMDA医疗器械承认审查分类及要求
PMDA开展的医疗器械承认审查,根据产品类型分为新医疗器械、改良医疗器械、仿制医疗器械三类,各类别审查要求差异化明确,确保审查的性与针对性:
1. 新医疗器械:与已批准的医疗器械在结构组成、使用方法、效果及性能方面有明显差异的产品,此类产品无明确审查标准,无论风险等级为Ⅱ、Ⅲ还是Ⅳ级,均由PMDA进行技术审评,审评通过后报厚生省承认。
2. 改良医疗器械:不属于新医疗器械或仿制医疗器械的产品,此类产品通常无明确审查标准,需由PMDA开展技术审评,经厚生省承认后上市。
3. 仿制医疗器械:与已批准的医疗器械在结构组成、使用方法、功能、效果及性能等方面具有等同性的产品,即本质上与已批准产品一致,申请认证或承认时无需提供临床试验数据。自2009年起,已有明确审查标准的仿制医疗器械,可由第三方认证机构认证;无审查标准的仿制医疗器械,仍需由PMDA审评、厚生省承认。
(四)PMDA再审查要求
根据日本新版《药事法》规定,初次获得批准的医疗器械,需在上市后经过一定时间开展再审查,确保产品长期使用的有效性,具体再审查时间要求如下:
- 新设计、结构新颖或采用新原理的医疗器械,在获得初次批准后第四年接受再审查;
- 具有新效力、新用途或新性能的医疗器械,在获得初次批准后第三年接受再审查。
四、核心总结
日本医疗器械监管体系以“风险分级、管控”为核心,通过清晰的分类标准、差异化的监管方式,实现了对不同风险等级医疗器械的全流程监管,既保障了产品有效,又兼顾了行业发展效率。PMDA作为核心执行机构,凭借专业化的审评团队、完善的业务体系,承担着审评审批、管控等关键职能,与厚生省、第三方认证机构协同,构建了严谨、的监管生态。
了解日本医疗器械分类标准、监管方式及PMDA核心职能,对于医疗器械企业拓展日本市场、合规开展生产经营活动,以及相关从业者掌握行业监管动态,具有重要的指导意义。